POR BRONSTED LOWRY
El concepto de Bronsted-Lowry define un ácido como una sustancia que puede
dar o donar un ión de hidrógeno o protón a otra sustancia, y una base como cualquier
sustancia que es capaz de recibir o de aceptar un ion hidrógeno o protón de otra sus-
tancia. En términos sencillos, un ácido es un donador de protones y una base es un re-
ceptor de protones. Cualquier sustancia que es un ácido o base de Arrhenius también
es un ácido o base de Bronsted-Lowry. Sin embargo, las definiciones de Bronsted -
Lowry son válidas sin importar el disolvente que se utilice para preparar la solución de
un ácido o una base. De acuerdo con el concepto Bronsted - Lowry, tanto los iones como las moléculas sin carga pueden ser ácidos o bases.
En las siguientes ecuaciones, las moléculas de HCL y HNO3, se comportan como
ácidos de Bronsted-Lowry donando los protones a una molécula de agua, que actúa como una base cuando acepta un protón.
HCL ( g ) + H2O ( l ) ----------> H3O (ac) + Cl - (ac)
HNO3 ( l ) + H2O ( l ) ----------> H3O + (ac) + NO3 - (ac)
El agua no siempre actúa como una base:
NH3 ( g ) + H2O ( l ) <======> NH4+ (ac) + OH - (ac)
En este caso el agua se está comportando como un ácido de Bronsted-Lowry puesto
que dona un protón a una molécula de amoniaco ( NH3 ) en una reaccción que se
desplaza de izquierda a derecha. Si consideramos la reacción inversa ( una reacción
que se desplaza de derecha a izquierda ) entonces el ion amonio actúa como un ácido
y el ión hidróxido como una base.
Una fecha doble( ==== ) indica que no todos los reactivos reaccionarán para dar
productos. En la ecuación superior, la flecha es más corta que la flecha inferior debido
a que son más moléculas de reactivos que las moléculas de producto cuando la reacci-
ón está en equilibrio. Si la flecha superior fuera más larga que la flecha inferior, esto
significaría que hay más moléculas de producto que moléculas de reactivo cuando la reacción se encuentra en equilibrio.
Algunas sustancias, por ejemplo el agua, son capaces de comportarse como un ácido o una base de Brosted-Lowry. Estas sustancias se llaman sustancias anfotéricas (amphi
que significa de "ambos tipos"). Una sustancia anfotérica es una sustancia que puede
actuar como ácido o como una base, según sea la naturaleza de la solución. El agua se
comporta como una base ( receptor de protones) con el cloruro de hidrógeno y como
un ácido con el amoniaco. Ciertos iones como el sulfato de azufre ( HSO4 - ) y el car-
bonato ácido ( HCO3 - ), son sustancias anfotéricas puesto que pueden donar y acep-
tar un protón. En cualquier reacción ácido-base o de transferencia de protones, tanto el
ácido como la base se encuentran en el lado de los reactivos y de los productos en la ecuación. por ejemplo:
HC2H3O2 (ac) + H2O ( l ) ----------> H3O + (ac) + C2H3O2 - (ac)
Se dara nombres especiales al ácido ( ácido 2 ) y la base ( base 2 ) que se encuentran
en el lado de los productos en el lado de l. El ácido 2 se llama ácido conjugado. Un
ácido conjugado es la sustancia que se forma cuando se adiciona un protón ( H + ) a
una base. La base y el ácido conjugado de esta reacción son H2O y H3O+ respecti-
vamente.A este par se le llama base-ácido conjugada. La base 2 se llama base conju-
gada. Una base conjugada es la sustancia que se forma cuando se elimina un protón
( H + ) de un ácido. El ácido y la base conjugada en esta reacción son: HC2H3O2 y
C2H3O2 - , respectivamente. A este par se le llama ácido-base conjugado.
KARINA GARCIA S. ;)

 indica que la reacción puede ocurrir en uno u otro sentido, directo e inverso.
indica que la reacción puede ocurrir en uno u otro sentido, directo e inverso.
![V_{rd} = k_d [A]^a [B]^b \,\!](http://upload.wikimedia.org/math/0/0/1/0019aee45e7f1a521b6d24cc730201a0.png)
![V_{ri} = k_i [C]^c [D]^d \,\!](http://upload.wikimedia.org/math/c/7/0/c7077484019e67a00a2a060aeedb42e6.png)
![k_{d} [A]_e^a [B]_e^b = k_i [C]_e^c [D]_e^d
\,\!](http://upload.wikimedia.org/math/9/f/8/9f8dc0def260f856d39a232d2f946423.png)
![\frac{k_{d}}{k_{i}}= \frac {[C]_{e}^{c}
[D]_{e}^{d}}{[A]_{e}^{a} [B]_{e}^{b}}](http://upload.wikimedia.org/math/b/5/6/b56f2b298b33400557428c225c3151b3.png)
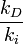 es una cantidad que depende de la temperatura del sistema reaccionante, y se la denomina la constante de equilibrio químico K (constante pues; aunque depende de la temperatura, no depende de las concentraciones de reactivos y productos).
es una cantidad que depende de la temperatura del sistema reaccionante, y se la denomina la constante de equilibrio químico K (constante pues; aunque depende de la temperatura, no depende de las concentraciones de reactivos y productos).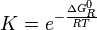
 es la energía libre de Gibbs normal de la reacción y su valor se calcula en función de propiedades termodinámicas de los reactivos y productos de la reacción.
es la energía libre de Gibbs normal de la reacción y su valor se calcula en función de propiedades termodinámicas de los reactivos y productos de la reacción.


