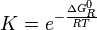El poliéster (C10H8O4) es una categoría de polímeros que contiene el grupo funcional éster en su cadena principal. Los poliésteres que existen en la naturaleza son conocidos desde 1830, pero el término poliéster generalmente se refiere a los poliésteres sintéticos (plásticos), provenientes de fracciones pesadas del petróleo. El poliéster termoplástico más conocido es el PET. El PET está formado sintéticamente con etilenglicol más tereftalato de dimetilo, produciendo el polímero o poltericoletano. Como resultado del proceso de polimerización, se obtiene la fibra, que en sus inicios fue la base para la elaboración de los hilos para coser y que actualmente tiene múltiples aplicaciones, como la fabricación de botellas de plástico que anteriormente se elaboraban con PVC. Se obtiene a través de la condensación de dioles (grupo funcional dihidroxilo).
Las resinas de poliéster (termoestables) son usadas también como matriz para la construcción de equipos, tuberías anticorrosivas y fabricación de pinturas. Para dar mayor resistencia mecánica suelen ir reforzadas con cortante, también llamado endurecedor o catalizador, sin purificar.
El poliéster es una resina termoestable obtenida por polimerización del estireno y otros productos químicos. Se endurece a la temperatura ordinaria y es muy resistente a la humedad, a los productos químicos y a las fuerzas mecánicas. Se usa en la fabricación de fibras, recubrimientos de láminas, etc.
para complementar este tema hicimos una practica en la cual fabrcamos un cuadro.
-primero nos dieron una madera
-a esta le pegamos un cromo
-despues pusimos pegamento sobre este y esperamos a que secara
-cuando seco agregamos arriba la resina mezclada con endurecedor
- esperamos 12 hrs. para que secara y quedara listo
HOLA! Bienvenidos a nuestro blog; esperamos y todo lo que nosotros subimos atreves de nuestros conocimientos que vamos obteniendo en la materia de Química III les sirvan y así como nosotros podemos publicar ustedes también pueden dejar sus comentarios; esperamos que este blog sea de su agrado. atte.: los alumnos del CCH Vallejo Grupo: 0510
Mostrando entradas con la etiqueta Por Eleonor. Mostrar todas las entradas
Mostrando entradas con la etiqueta Por Eleonor. Mostrar todas las entradas
miércoles, 27 de abril de 2011
miércoles, 19 de enero de 2011
tipos de enlace
Los átomos se unen entre sí para formar moléculas mediante fuerzas de enlace. Los tipos fundamentales de enlace son el iónico, el covalente y el metálico. A continuación se describen cada uno de los tipos de enlace y sus características principales.
Un ejemplo de sustancia con enlace iónico es el cloruro sódico. En su formación tiene lugar la transferencia de un electrón del átomo de sodio al átomo de cloro. Las configuraciones electrónicas de estos elementos después del proceso de ionización son muy importantes, ya que lo dos han conseguido la configuración externa correspondiente a los gases nobles, ganando los átomos en estabilidad. Se produce una transferencia electrónica, cuyo déficit se cubre sobradamente con la energía que se libera al agruparse los iones formados en una red cristalina que, en el caso del cloruro sódico, es una red cúbica en la que en los vértices del paralelepípedo fundamental alternan iones Cl- y Na+. De esta forma cada ion Cl- queda rodeado de seis iones Na+ y recíprocamente. Se llama índice de coordinación al número de iones de signo contrario que rodean a uno determinado en una red cristalina. En el caso del NaCl, el índice de coordinación es 6 para ambos
Por otra parte, la aparición de fuerzas repulsivas muy intensas cuando dos iones se aproximan a distancias inferiores a la distancia reticular (distancia en la que quedan en la red dos iones de signo contrario), hace que los cristales iónicos sean muy poco compresibles. Hay sustancias cuyas moléculas, si bien son eléctricamente neutras, mantienen una separación de cargas. Esto se debe a que no hay coincidencia entre el centro de gravedad de las cargas positivas y el de las negativas: la molécula es un dipolo, es decir, un conjunto de dos cargas iguales en valor absoluto pero de distinto signo, separadas a una cierta distancia. Los dipolos se caracterizan por su momento; producto del valor absoluto de una de las cargas por la distancia que las separa. Un de estas sustancias polares es, por ejemplo el agua.
Cuando un compuesto iónico se introduce en un disolvente polar, los iones de la superficie de cristal provocan a su alrededor una orientación de las moléculas dipolares, que enfrentan hacia cada ion sus extremos con carga opuesta a la del mismo. En este proceso de orientación se libera una energía que, si supera a la energía reticular, arranca al ion de la red. Una vez arrancado, el ion se rodea de moléculas de disolvente: queda solvatado. Las moléculas de disolvente alrededor de los iones se comportan como capas protectoras que impiden la reagrupación de los mismos. Todo esto hace que, en general, los compuestos iónicos sean solubles en disolventes polares, aunque dependiendo siempre la solubilidad del valor de la energía reticular y del momento dipolar del disolvente. Así, un compuesto como el NaCl, es muy soluble en disolventes como el agua, y un compuesto como el sulfato de bario, con alta energía reticular, no es soluble en los disolventes de momento dipolar muy elevado.
Es posible también la formación de enlaces múltiples, o sea, la compartición de más de un par de electrones por una pareja de átomos. En otros casos, el par compartido es aportado por sólo uno de los átomos, formándose entonces un enlace que se llama coordinado o dativo. Se han encontrado compuestos covalentes en donde no se cumple la regla. Por ejemplo, en BCl3, el átomo de boro tiene seis electrones en la última capa, y en SF6, el átomo de azufre consigue hasta doce electrones. Esto hace que actualmente se piense que lo característico del enlace covalente es la formación de pares electrónicos compartidos, independientemente de su número.
En el enlace metálico, los átomos se transforman en iones y electrones, en lugar de pasar a un átomo adyacente, se desplazan alrededor de muchos átomos. Intuitivamente, la red cristalina metálica puede considerarse formada por una serie de átomos alrededor de los cuales los electrones sueltos forman una nube que mantiene unido al conjunto.
http://www.textoscientificos.com/quimica/enlaces-quimicos
Enlace iónico
El enlace iónico consiste en la atracción electrostática entre átomos con cargas eléctricas de signo contrario. Este tipo de enlace se establece entre átomos de elementos poco electronegativos con los de elementos muy electronegativos. Es necesario que uno de los elementos pueda ganar electrones y el otro perderlo, y como se ha dicho anteriormente este tipo de enlace se suele producir entre un no metal (electronegativo) y un metal (electropositivo).Un ejemplo de sustancia con enlace iónico es el cloruro sódico. En su formación tiene lugar la transferencia de un electrón del átomo de sodio al átomo de cloro. Las configuraciones electrónicas de estos elementos después del proceso de ionización son muy importantes, ya que lo dos han conseguido la configuración externa correspondiente a los gases nobles, ganando los átomos en estabilidad. Se produce una transferencia electrónica, cuyo déficit se cubre sobradamente con la energía que se libera al agruparse los iones formados en una red cristalina que, en el caso del cloruro sódico, es una red cúbica en la que en los vértices del paralelepípedo fundamental alternan iones Cl- y Na+. De esta forma cada ion Cl- queda rodeado de seis iones Na+ y recíprocamente. Se llama índice de coordinación al número de iones de signo contrario que rodean a uno determinado en una red cristalina. En el caso del NaCl, el índice de coordinación es 6 para ambos
Propiedades de los compuestos iónicos
Las sustancias iónicas están constituidas por iones ordenados en el retículo cristalino; las fuerzas que mantienen esta ordenación son fuerzas de Coulomb, muy intensas. Esto hace que las sustancias iónicas sean sólidos cristalinos con puntos de fusión elevados. En efecto, para fundir un cristal iónico hay que deshacer la red cristalina, separar los iones. El aporte de energía necesario para la fusión, en forma de energía térmica, ha de igualar al de energía reticular, que es la energía desprendida en la formación de un mol de compuesto iónico sólido a partir de los correspondientes iones en estado gaseoso. Esto hace que haya una relación entre energía reticular y punto de fusión, siendo éste tanto más elevado cuanto mayor es el valor de aquella.Por otra parte, la aparición de fuerzas repulsivas muy intensas cuando dos iones se aproximan a distancias inferiores a la distancia reticular (distancia en la que quedan en la red dos iones de signo contrario), hace que los cristales iónicos sean muy poco compresibles. Hay sustancias cuyas moléculas, si bien son eléctricamente neutras, mantienen una separación de cargas. Esto se debe a que no hay coincidencia entre el centro de gravedad de las cargas positivas y el de las negativas: la molécula es un dipolo, es decir, un conjunto de dos cargas iguales en valor absoluto pero de distinto signo, separadas a una cierta distancia. Los dipolos se caracterizan por su momento; producto del valor absoluto de una de las cargas por la distancia que las separa. Un de estas sustancias polares es, por ejemplo el agua.
Cuando un compuesto iónico se introduce en un disolvente polar, los iones de la superficie de cristal provocan a su alrededor una orientación de las moléculas dipolares, que enfrentan hacia cada ion sus extremos con carga opuesta a la del mismo. En este proceso de orientación se libera una energía que, si supera a la energía reticular, arranca al ion de la red. Una vez arrancado, el ion se rodea de moléculas de disolvente: queda solvatado. Las moléculas de disolvente alrededor de los iones se comportan como capas protectoras que impiden la reagrupación de los mismos. Todo esto hace que, en general, los compuestos iónicos sean solubles en disolventes polares, aunque dependiendo siempre la solubilidad del valor de la energía reticular y del momento dipolar del disolvente. Así, un compuesto como el NaCl, es muy soluble en disolventes como el agua, y un compuesto como el sulfato de bario, con alta energía reticular, no es soluble en los disolventes de momento dipolar muy elevado.
Enlace covalente
Lewis expuso la teoría de que todos los elementos tienen tendencia a conseguir configuración electrónica de gas noble (8 electrones en la última capa). Elementos situados a la derecha de la tabla periódica ( no metales ) consiguen dicha configuración por captura de electrones; elementos situados a la izquierda y en el centro de la tabla ( metales ), la consiguen por pérdida de electrones. De esta forma la combinación de un metal con un no metal se hace por enlace iónico; pero la combinación de no metales entre sí no puede tener lugar mediante este proceso de transferencia de electrones; por lo que Lewis supuso que debían compartirlos.Es posible también la formación de enlaces múltiples, o sea, la compartición de más de un par de electrones por una pareja de átomos. En otros casos, el par compartido es aportado por sólo uno de los átomos, formándose entonces un enlace que se llama coordinado o dativo. Se han encontrado compuestos covalentes en donde no se cumple la regla. Por ejemplo, en BCl3, el átomo de boro tiene seis electrones en la última capa, y en SF6, el átomo de azufre consigue hasta doce electrones. Esto hace que actualmente se piense que lo característico del enlace covalente es la formación de pares electrónicos compartidos, independientemente de su número.
Fuerzas intermoleculares
A diferencia que sucede con los compuestos iónicos, en las sustancias covalentes existen moléculas individualizadas. Entre estas moléculas se dan fuerzas de cohesión o de Van der Waals, que debido a su debilidad, no pueden considerarse ya como fuerzas de enlace. Hay varios tipos de interacciones: Fuerzas de orientación (aparecen entre moléculas con momento dipolar diferente), fuerzas de inducción (ion o dipolo permanente producen en una molécula no polar una separación de cargas por el fenómeno de inducción electrostática) y fuerzas de dispersión (aparecen en tres moléculas no polares).Propiedades de los compuestos covalentes
Las fuerzas de Van der Waals pueden llegar a mantener ordenaciones cristalinas, pero los puntos de fusión de las sustancias covalentes son siempre bajos, ya que la agitación térmica domina, ya a temperaturas bajas, sobre las débiles fuerzas de cohesión. La mayor parte de las sustancias covalentes, a temperatura ambiente, son gases o líquidos de punto de ebullición bajo (por ejemplo el agua). En cuanto a la solubilidad, puede decirse que, en general, las sustancias covalentes son solubles en disolventes no polares y no lo son en disolventes polares. Se conocen algunos sólidos covalentes prácticamente infusibles e insolubles, que son excepción al comportamiento general descrito. Un ejemplo de ellos es el diamante. La gran estabilidad de estas redes cristalinas se debe a que los átomos que las forman están unidos entre sí mediante enlaces covalentes. Para deshacer la red es necesario romper estos enlaces, los cual consume enormes cantidades de energíaElectrovalencia y covalencia
Teniendo presenta las teorías de los enlaces iónicos y covalentes, es posible deducir la valencia de un elemento cualquiera a partir de su configuración electrónica.- La electrovalencia, valencia en la formación de compuestos iónicos, es el número de electrones que el átomo tiene que ganar o perder para conseguir la configuración de los gases nobles.
- La covalencia, número de enlaces covalentes que puede formar un átomo, es el número de electrones desapareados que tiene dicho átomo. Hay que tener presente que un átomo puede desaparecer sus electrones al máximo siempre que para ello no haya de pasar ningún electrón a un nivel energético superior.
ENLACE METÁLICO
Los elementos metálicos sin combinar forman redes cristalinas con elevado índice de coordinación. Hay tres tipos de red cristalina metálica: cúbica centrada en las caras, con coordinación doce; cúbica centrada en el cuerpo, con coordinación ocho, y hexagonal compacta, con coordinación doce. Sin embargo, el número de electrones de valencia de cualquier átomo metálico es pequeño, en todo caso inferior al número de átomos que rodean a un dado, por lo cual no es posible suponer el establecimiento de tantos enlaces covalentes.En el enlace metálico, los átomos se transforman en iones y electrones, en lugar de pasar a un átomo adyacente, se desplazan alrededor de muchos átomos. Intuitivamente, la red cristalina metálica puede considerarse formada por una serie de átomos alrededor de los cuales los electrones sueltos forman una nube que mantiene unido al conjunto.
POLARIDAD DE LOS ENLACES
En el caso de moléculas heteronucleares, uno de los átomos tendrá mayor electronegatividad que el otro y, en consecuencia, atraerá mas fuertemente hacia sí al par electrónico compartido. El resultado es un desplazamiento de la carga negativa hacia el átomo más electronegativo, quedando entonces el otro con un ligero exceso de carga positiva. Por ejemplo, en la molécula de HCl la mayor electronegatividad del cloro hace que sobre éste aparezca una fracción de carga negativa, mientras que sobre el hidrógeno aparece una positiva de igual valor absoluto. Resulta así una molécula polar, con un enlace intermedio entre el covalente y el iónico.http://www.textoscientificos.com/quimica/enlaces-quimicos
domingo, 16 de enero de 2011
configuracion electronica
Llenado de orbitales y notación.
Para obtener la configuración electrónica de un elemento, los estados se van ocupando por electrones según la energía de estos estados, ocupándose primero los de menor energía. Por el hecho de que el estado 3d (n=3 y l=2) está más alto en energía que el 4s (n=4 y l=0), existen los metales de transición; y como en el orbital d caben 10 electrones según la primera tabla (o bien haciendo l=2 en 2(2l+1)=10), hay diez elementos en cada serie de transición. Lo mismo ocurre con otros bloques de elementos que se pueden ver en la tabla periódica de los elementos.
Se suele emplear una regla mnemotécnica consistente en hacer una tabla en donde en la primera columna se escribe 1s, 2s, 3s,..., en la segunda columna, saltándose una fila, 2p, 3p,... y así sucesivamente. Los primeros niveles que se van llenando con electrones son los que quedan más a la derecha y arriba de la tabla, como indica el sentido de las flechas en el diagrama:
Concretamente, en el diagrama se llenan hasta el 3d, comenzando la primera serie de transición. Si por ejemplo se quiere saber la configuración electrónica del vanadio (Z=23), con el diagrama obtendríamos:
Para obtener la configuración electrónica de un elemento, los estados se van ocupando por electrones según la energía de estos estados, ocupándose primero los de menor energía. Por el hecho de que el estado 3d (n=3 y l=2) está más alto en energía que el 4s (n=4 y l=0), existen los metales de transición; y como en el orbital d caben 10 electrones según la primera tabla (o bien haciendo l=2 en 2(2l+1)=10), hay diez elementos en cada serie de transición. Lo mismo ocurre con otros bloques de elementos que se pueden ver en la tabla periódica de los elementos.
Se suele emplear una regla mnemotécnica consistente en hacer una tabla en donde en la primera columna se escribe 1s, 2s, 3s,..., en la segunda columna, saltándose una fila, 2p, 3p,... y así sucesivamente. Los primeros niveles que se van llenando con electrones son los que quedan más a la derecha y arriba de la tabla, como indica el sentido de las flechas en el diagrama:
Concretamente, en el diagrama se llenan hasta el 3d, comenzando la primera serie de transición. Si por ejemplo se quiere saber la configuración electrónica del vanadio (Z=23), con el diagrama obtendríamos:
- Llenado de orbitales: 1s2 2s2 2p6 3s2 3p6 4s2 3d3 (2 + 2 + 6 + 2 + 6 + 2 + 3 = 23)
configuracion electronica
En Química, la configuración electrónica es el modo en el cual los electrones están ordenados en un átomo. Como los electrones son fermiones están sujetos al principio de exclusión de Pauli, que dice que dos fermiones no pueden estar en el mismo estado cuántico a la vez. Por lo tanto, en el momento en que un estado es ocupado por un electrón, el siguiente electrón debe ocupar un estado mecanocuántico diferente.
En el átomo, los estados estacionarios de la función de onda de un electrón (los estados que son función propia de la ecuación de Schrödinger HΨ = EΨ en donde H es el hamiltoniano) se denominan orbitales, por analogía con la clásica imagen de los electrones orbitando alrededor del núcleo. Estos estados tienen cuatro números cuánticos: n, l, m y s, y, en resumen, el principio de exclusión de Pauli quiere decir que no puede haber dos electrones en un mismo átomo con los cuatro valores de los números cuánticos iguales. Los más importantes de estos son el n y el l.
En el átomo, los estados estacionarios de la función de onda de un electrón (los estados que son función propia de la ecuación de Schrödinger HΨ = EΨ en donde H es el hamiltoniano) se denominan orbitales, por analogía con la clásica imagen de los electrones orbitando alrededor del núcleo. Estos estados tienen cuatro números cuánticos: n, l, m y s, y, en resumen, el principio de exclusión de Pauli quiere decir que no puede haber dos electrones en un mismo átomo con los cuatro valores de los números cuánticos iguales. Los más importantes de estos son el n y el l.
martes, 23 de noviembre de 2010
reaccion irreversible
Una reacción reversible es una reacción química que se efectúa en ambos sentidos simultáneamente, es decir, los productos reaccionan entre sí y regeneran a los reactivos. Consideremos por ejemplo la reacción de los reactivos A y B que se unen para dar los productos C y D, ésta puede simbolizarse con la siguiente ecuación química
 indica que la reacción puede ocurrir en uno u otro sentido, directo e inverso.
indica que la reacción puede ocurrir en uno u otro sentido, directo e inverso.
Puesto que la reacción puede proceder en ambas direcciones y el sentido neto de la reacción está definido por la presión, la temperatura y la concentración relativa de reactivos y productos en el medio en que se desarrolla, la definición de reactivos y productos en este tipo de reacciones es convencional y está dada por el tipo de proceso estudiado.
Los reactivos suelen estar en su máxima concentración al principio de la reacción, pero a medida que la reacción evoluciona y la concentración de los productos aumenta, también se incrementa la velocidad de la reacción inversa. Cuando este tipo de reacciones se llevan a cabo para obtener determinado producto suele ser necesario ir separando dicho producto del medio que reacciona a medida que se van introduciendo los reactivos.
Si no existe intervención externa (adición de reactivos, separación de productos o cambio de las condiciones de operación definidas básicamente por la presión y la temperatura) estas reacciones evolucionan espontáneamente hacia un estado de equilibrio en el que la velocidad de formación de productos iguala a la velocidad en que estos se transforman en reactivos. Entonces, en el punto de equilibrio la velocidad neta de reacción, igual a la velocidad de la reacción directa menos la de la reacción inversa, es cero.
En el equilibrio se cumple que:
Las velocidades de reacción directa e inversa son proporcionales a las concentraciones involucradas (un tratamiento riguroso requiere el empleo de actividades en lugar de concentraciones), tendremos:
El cociente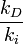 es una cantidad que depende de la temperatura del sistema reaccionante, y se la denomina la constante de equilibrio químico K (constante pues; aunque depende de la temperatura, no depende de las concentraciones de reactivos y productos).
es una cantidad que depende de la temperatura del sistema reaccionante, y se la denomina la constante de equilibrio químico K (constante pues; aunque depende de la temperatura, no depende de las concentraciones de reactivos y productos).
De las ecuaciones fundamentales de la termodinámica se deduce que:
 es la energía libre de Gibbs normal de la reacción y su valor se calcula en función de propiedades termodinámicas de los reactivos y productos de la reacción.
es la energía libre de Gibbs normal de la reacción y su valor se calcula en función de propiedades termodinámicas de los reactivos y productos de la reacción.
Ejemplos de reacciones reversibles son las soluciones de ácidos y bases débiles: Cuando un ácido o base débil se mezcla con agua, se forman cationes oxonio (H3O+) y aniones hidroxilo (OH−), como productos de reacción, que se recombinan con el resto de producto ácido o básico para dar nuevamente el ácido o base originales y agua.
 indica que la reacción puede ocurrir en uno u otro sentido, directo e inverso.
indica que la reacción puede ocurrir en uno u otro sentido, directo e inverso.Puesto que la reacción puede proceder en ambas direcciones y el sentido neto de la reacción está definido por la presión, la temperatura y la concentración relativa de reactivos y productos en el medio en que se desarrolla, la definición de reactivos y productos en este tipo de reacciones es convencional y está dada por el tipo de proceso estudiado.
Los reactivos suelen estar en su máxima concentración al principio de la reacción, pero a medida que la reacción evoluciona y la concentración de los productos aumenta, también se incrementa la velocidad de la reacción inversa. Cuando este tipo de reacciones se llevan a cabo para obtener determinado producto suele ser necesario ir separando dicho producto del medio que reacciona a medida que se van introduciendo los reactivos.
Si no existe intervención externa (adición de reactivos, separación de productos o cambio de las condiciones de operación definidas básicamente por la presión y la temperatura) estas reacciones evolucionan espontáneamente hacia un estado de equilibrio en el que la velocidad de formación de productos iguala a la velocidad en que estos se transforman en reactivos. Entonces, en el punto de equilibrio la velocidad neta de reacción, igual a la velocidad de la reacción directa menos la de la reacción inversa, es cero.
En el equilibrio se cumple que:
Las velocidades de reacción directa e inversa son proporcionales a las concentraciones involucradas (un tratamiento riguroso requiere el empleo de actividades en lugar de concentraciones), tendremos:
El cociente
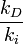 es una cantidad que depende de la temperatura del sistema reaccionante, y se la denomina la constante de equilibrio químico K (constante pues; aunque depende de la temperatura, no depende de las concentraciones de reactivos y productos).
es una cantidad que depende de la temperatura del sistema reaccionante, y se la denomina la constante de equilibrio químico K (constante pues; aunque depende de la temperatura, no depende de las concentraciones de reactivos y productos).De las ecuaciones fundamentales de la termodinámica se deduce que:
 es la energía libre de Gibbs normal de la reacción y su valor se calcula en función de propiedades termodinámicas de los reactivos y productos de la reacción.
es la energía libre de Gibbs normal de la reacción y su valor se calcula en función de propiedades termodinámicas de los reactivos y productos de la reacción.Ejemplos de reacciones reversibles son las soluciones de ácidos y bases débiles: Cuando un ácido o base débil se mezcla con agua, se forman cationes oxonio (H3O+) y aniones hidroxilo (OH−), como productos de reacción, que se recombinan con el resto de producto ácido o básico para dar nuevamente el ácido o base originales y agua.
reaccion reversible
A reacción reversible es a reacción química eso da lugar a equilibrio mezcla de reactivo y productos. Para una reacción que implica dos reactivo y dos productos esto se puede expresar simbólicamente como
- ⇌ del aA + del bB cc + DD
A y B pueden reaccionar a la forma C y D o, en la reacción, la C y la D reversas pueden reaccionar a la forma A y B. Esto es distinto de proceso reversible en termodinámica.
concentraciones de reactivo y de productos en una mezcla del equilibrio son determinados por concentraciones analíticas de los reactivo (A y B o C y D) y constante de equilibrio, K. Alternadamente la magnitud de la constante de equilibrio depende de Gibbs libera energía cambie para la reacción. Así pues, cuando el cambio libre de la energía es grande (más que cerca de 30 kJ mol-1), la constante de equilibrio es grande (el registro K > 3) y las concentraciones de los reactivo en el equilibrio son muy pequeñas. Tal reacción se llama reacción irreversible. Vea también irrevocabilidad.
Historia
El concepto de una reacción reversible fue introducido cerca Berthollet en 1803, después de que él hubiera observado la formación de carbonato de sodio cristales en el borde de a lago de la sal.
- 2NaCl + CaCO3 Na del →2CO3 + CaCl2
Él reconoció esto como el revés de la reacción familiar
- Na2CO3 + CaCl2→ 2NaCl + CaCO3
Hasta entonces, reacciones químicas fueron pensados para proceder siempre en una dirección. Berthollet razonó que el exceso de sal hacia adentro el lago ayudado empuje la reacción “reversa” hacia la formación del carbonato de sodio. Le Chatelier amplió más adelante esta idea a una declaración más general de los efectos sobre el equilibrio de varios factores.
miércoles, 1 de septiembre de 2010
Industria Papelera
Evolución y estructura de la industria
Se cree que la fabricación de papel tiene su origen en China
hacia el año 100 d.C.: se utilizaban trapos, cáñamo, paja y hierba
como materias primas y se golpeaban contra morteros de piedra
para separar la fibra original. Aunque con el tiempo ganó terreno
la mecanización, hasta el siglo XIX siguieron utilizándose
los métodos de producción por lotes y las fuentes de fibra agrícolas.
Las primeras máquinas continuas de papel se patentaron
en los años de cambio del siglo XIX al XX. Entre 1844 y 1884 se
desarrollaron los primeros métodos para la obtención de pasta de
madera, una fuente de fibra más abundante que los trapos o las
hierbas; estos métodos implicaban la abrasión mecánica y la aplicación
de procedimientos químicos a base de sosa cáustica,
sulfitos y sulfatos (Celulosa al sulfato). Con estos cambios se inició
la era moderna de la fabricación de pasta y de papel.
El papel es esencialmente una hoja hecha de fibras a la que se añaden varias sustancias químicas
para modificar sus propiedades y su calidad. Además de fibras y sustancias químicas, la
fabricación de papel requiere grandes cantidades de agua y energía en forma de vapor y
electricidad. En consecuencia, los principales problemas medioambientales asociados a la
producción de papel son las emisiones a las aguas, las emisiones atmosféricas y el consumo de
energía. Es previsible que los residuos se conviertan en un problema cada vez mayor.
La pasta papelera puede obtenerse a partir de fibra virgen por medios químicos o mecánicos o
bien a partir de papel recuperado. Una fábrica de papel puede limitarse a reconstituir la pasta
fabricada en otro lugar o integrarse con el proceso de desfibrado en el mismo establecimiento.
martes, 31 de agosto de 2010
INFORMACION SOBRE LA INDUSTRIA DEL PAPEL
EL PAPEL
1. Introducción:
Los árboles, fibra vegetal viva:
El papel se compone de fibras vegetales, es decir, de materia orgánica, o lo que es lo mismo, de elementos que están o han estado vivos. Por este motivo debemos aprender a valorar la importancia del papel como exponente y resultado de un proceso de fabricación, que ha tenido como consecuencia la muerte de un ser vivo: EL ÁRBOL.
De igual modo que confundimos dinero con bienestar, de la misma manera que pensamos, que al mover dinero manejamos posibilidades, debemos concienciarnos de que, al utilizar papel, aprovechamos parte de la riqueza viva del planeta, y si no la cuidamos, corremos el riesgo de perderla.
La repercusión que tendrá en un futuro la sobreexplotación de los recursos madereros sólo podrá sufrirlo las próximas generaciones. Es pues una labor importante y difícil la que se nos plantea: ser conscientes de que la abundancia de hoy puede ser escasez maña
EL PAPEL
1. Introducción:
Los árboles, fibra vegetal viva:
El papel se compone de fibras vegetales, es decir, de materia orgánica, o lo que es lo mismo, de elementos que están o han estado vivos. Por este motivo debemos aprender a valorar la importancia del papel como exponente y resultado de un proceso de fabricación, que ha tenido como consecuencia la muerte de un ser vivo: EL ÁRBOL.
De igual modo que confundimos dinero con bienestar, de la misma manera que pensamos, que al mover dinero manejamos posibilidades, debemos concienciarnos de que, al utilizar papel, aprovechamos parte de la riqueza viva del planeta, y si no la cuidamos, corremos el riesgo de perderla.
La repercusión que tendrá en un futuro la sobreexplotación de los recursos madereros sólo podrá sufrirlo las próximas generaciones. Es pues una labor importante y difícil la que se nos plantea: ser conscientes de que la abundancia de hoy puede ser escasez maña
Suscribirse a:
Entradas (Atom)




![V_{rd} = k_d [A]^a [B]^b \,\!](http://upload.wikimedia.org/math/0/0/1/0019aee45e7f1a521b6d24cc730201a0.png)
![V_{ri} = k_i [C]^c [D]^d \,\!](http://upload.wikimedia.org/math/c/7/0/c7077484019e67a00a2a060aeedb42e6.png)
![k_{d} [A]_e^a [B]_e^b = k_i [C]_e^c [D]_e^d
\,\!](http://upload.wikimedia.org/math/9/f/8/9f8dc0def260f856d39a232d2f946423.png)
![\frac{k_{d}}{k_{i}}= \frac {[C]_{e}^{c}
[D]_{e}^{d}}{[A]_{e}^{a} [B]_{e}^{b}}](http://upload.wikimedia.org/math/b/5/6/b56f2b298b33400557428c225c3151b3.png)