 indica que la reacción puede ocurrir en uno u otro sentido, directo e inverso.
indica que la reacción puede ocurrir en uno u otro sentido, directo e inverso.Puesto que la reacción puede proceder en ambas direcciones y el sentido neto de la reacción está definido por la presión, la temperatura y la concentración relativa de reactivos y productos en el medio en que se desarrolla, la definición de reactivos y productos en este tipo de reacciones es convencional y está dada por el tipo de proceso estudiado.
Los reactivos suelen estar en su máxima concentración al principio de la reacción, pero a medida que la reacción evoluciona y la concentración de los productos aumenta, también se incrementa la velocidad de la reacción inversa. Cuando este tipo de reacciones se llevan a cabo para obtener determinado producto suele ser necesario ir separando dicho producto del medio que reacciona a medida que se van introduciendo los reactivos.
Si no existe intervención externa (adición de reactivos, separación de productos o cambio de las condiciones de operación definidas básicamente por la presión y la temperatura) estas reacciones evolucionan espontáneamente hacia un estado de equilibrio en el que la velocidad de formación de productos iguala a la velocidad en que estos se transforman en reactivos. Entonces, en el punto de equilibrio la velocidad neta de reacción, igual a la velocidad de la reacción directa menos la de la reacción inversa, es cero.
En el equilibrio se cumple que:
Las velocidades de reacción directa e inversa son proporcionales a las concentraciones involucradas (un tratamiento riguroso requiere el empleo de actividades en lugar de concentraciones), tendremos:
El cociente
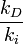 es una cantidad que depende de la temperatura del sistema reaccionante, y se la denomina la constante de equilibrio químico K (constante pues; aunque depende de la temperatura, no depende de las concentraciones de reactivos y productos).
es una cantidad que depende de la temperatura del sistema reaccionante, y se la denomina la constante de equilibrio químico K (constante pues; aunque depende de la temperatura, no depende de las concentraciones de reactivos y productos).De las ecuaciones fundamentales de la termodinámica se deduce que:
 es la energía libre de Gibbs normal de la reacción y su valor se calcula en función de propiedades termodinámicas de los reactivos y productos de la reacción.
es la energía libre de Gibbs normal de la reacción y su valor se calcula en función de propiedades termodinámicas de los reactivos y productos de la reacción.Ejemplos de reacciones reversibles son las soluciones de ácidos y bases débiles: Cuando un ácido o base débil se mezcla con agua, se forman cationes oxonio (H3O+) y aniones hidroxilo (OH−), como productos de reacción, que se recombinan con el resto de producto ácido o básico para dar nuevamente el ácido o base originales y agua.


![V_{rd} = k_d [A]^a [B]^b \,\!](http://upload.wikimedia.org/math/0/0/1/0019aee45e7f1a521b6d24cc730201a0.png)
![V_{ri} = k_i [C]^c [D]^d \,\!](http://upload.wikimedia.org/math/c/7/0/c7077484019e67a00a2a060aeedb42e6.png)
![k_{d} [A]_e^a [B]_e^b = k_i [C]_e^c [D]_e^d
\,\!](http://upload.wikimedia.org/math/9/f/8/9f8dc0def260f856d39a232d2f946423.png)
![\frac{k_{d}}{k_{i}}= \frac {[C]_{e}^{c}
[D]_{e}^{d}}{[A]_{e}^{a} [B]_{e}^{b}}](http://upload.wikimedia.org/math/b/5/6/b56f2b298b33400557428c225c3151b3.png)
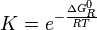
disculpen pero me confundi con esta haber si les gusta si no mmm diganme no se preocupen no me enojo
ResponderEliminarde igual manera pienso eso, puesto se es demaciado texto y bueno es un poco confuso amm kien es el autor del comentario anterior??
ResponderEliminarATT:SALVADOR REYES
CREO QUE ES ELEONOR LA DEL PRIMER COMENTARIO, OR LA ETIQUETA.
ResponderEliminarPERO SI CREO QUE ES UN POCO CONFUSO POR DEMASIADO TEXTO. TENDREMOS QUE LEERLO COMO DOS VECES PARA PODER COMPRENDERLO.
ATTE: KIARA FLORES